吸附柱层析法是分离、纯化有机混合物的一种重要方法。它是根据混合物中各组分的分子结构和性质(极性)来选择合适的吸附剂和洗脱剂,从而利用吸附剂对各组分吸附能力的不同及各组分在洗脱剂中的溶解性能不同达到分离目的。当混合物溶液流过吸附柱时,各组分同时被吸附在柱的上端,然后从柱顶不断加入溶剂(洗
菠菜色素的提取与分离
修改稿
一、实验目的
1、通过绿色植物色素的提取和分离,了解天然物质分离提纯方法;
2、了解柱层析和薄层色谱分离的基本原理,掌握柱层析和薄层色谱分离的操作技术。
3、通过柱色谱和薄层色谱分离操作,加深了解微量有机物色谱分离鉴定的原理。
二、实验原理
层析法是一种物理分离方法。

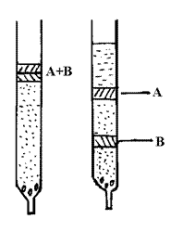
吸附柱层析法是分离、纯化有机混合物的一种重要方法。它是根据混合物中各组分的分子结构和性质(极性)来选择合适的吸附剂和洗脱剂,从而利用吸附剂对各组分吸附能力的不同及各组分在洗脱剂中的溶解性能不同达到分离目的。当混合物溶液流过吸附柱时,各组分同时被吸附在柱的上端,然后从柱顶不断加入溶剂(洗
脱剂)洗脱。由于不同化合物吸附能力不同,从而随着溶剂下移的速度不同,于是混合物中各组分按吸附剂对它们所吸附的强弱顺序在柱中自上而下形成了若干色带,如图所示。
绿色植物如菠菜叶中的叶绿体含有绿色素(包括叶绿素a和叶绿素b)和黄色素(包括胡萝卜素和叶黄素)两大类天然色素。这两类色素都不溶于水,而溶于有机溶剂,故可用乙醇或丙酮等有机溶剂提取。
叶绿素存在叶绿素a(C55H72O5N4Mg)和叶绿素b(C55H70O6N4Mg) 两种结构相似的形式,其差别是叶绿素a中一个甲基被甲酰基所取代从而形成了叶绿素b。它们都是吡咯衍生物与金属镁的络合物,是植物进行光合作用所必需的催化剂。植物中叶绿素a 的含量通常是b 的3 倍。尽管叶绿素分子中含有一些极性基团,但大的烃基结构使它易溶于醚、石油醚等一些非极性的溶剂。
胡萝卜素(C40H56)是具有长链结构的共轭多烯。它有三种异构体,即a-胡萝卜素、β-胡萝卜素和γ-胡萝卜素,其中β-胡萝卜素含量最多,也最重要。
叶黄素(C40H56O2)是胡萝卜素的羟基衍生物,它在绿叶中的含量通常是胡萝卜素的两倍。与胡萝卜素相比,叶黄素较易溶于醇而在石油醚中溶解度较小。
本实验是用硅胶作吸附剂,分离菠菜中胡萝卜素、叶黄素、叶绿素a和叶绿素b。
三、仪器与试剂
仪器:研钵、布氏漏斗、圆底烧瓶、直形冷凝管、色谱柱、抽滤瓶、烧杯、铁架台、723分光光度计
试剂:硅胶板,200-300目硅胶,甲醇,石油醚(60-90℃),丙酮,乙酸乙酯,正丁醇,乙醇,菠菜叶。
四、实验内容
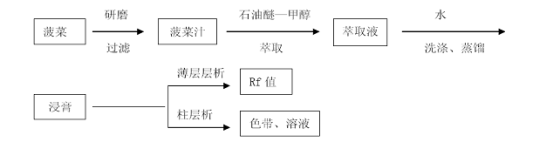
1、菠菜色素的提取
取10 g新鲜菠菜叶,剪碎后放入研钵中,与10 mL甲醇拌匀研磨5分钟,用布氏漏斗抽滤。滤渣再用10 mL的石油醚-甲醇(3:2)混合液进行研磨提取两次。合并液转入分液漏斗中,用10 mL水洗2次,弃去甲醇层(如果不分层,可加5ml左右的石油醚),石油醚层用无水硫酸钠进行干燥后过滤到圆底烧瓶中,在水浴中蒸去大部分石油醚至体积约1mL(也可以不浓缩)。
2、薄层层析
将上述的浓缩液点在硅胶G的预制板上,分别用石油醚-丙酮(8:2)和石油醚-乙酸乙酯(6:4)两种溶剂系统展开,经过显色后,进行观察并计算Rf值(比移值)。
3、柱层析
在40*1.5cm的具塞层析柱中,加入约10cm高的石油醚-乙酸乙酯=6:4的混合溶液,然后加入10g硅胶与10ml石油醚-乙酸乙酯=6:4溶液的混合物,打开下面的活塞,放出溶剂到溶液界面在硅胶表面高2-3mm为止。再加入约0.5cm(约2g)高石英砂(或者无水硫酸钠)。
【或者在20*1.0cm的层析柱中,加入约8cm高的石油醚-乙酸乙酯=6:4的混合溶液,然后加入4 g硅胶与5ml石油醚-乙酸乙酯=6:4溶液的混合物,打开下面的活塞,放出溶剂到溶液界面在硅胶表面高2-3mm为止。再加入约0.5cm(约1g)高石英砂(或者无水硫酸钠)】。
将浓缩液小心地从柱顶部加入。加完后打开活塞,让液面下降到柱中石英砂(或者硫酸钠)层,关闭活塞,加几滴石油醚-乙酸乙酯=6:4溶液冲洗内壁,打开活塞,直到硅胶表面剩下1-2mm高为止。
待色素全部进入柱体后,往柱顶小心加入5ml石油醚-乙酸乙酯=6:4的混合溶液(后面每次补加2-5ml),打开下面的活塞,当第一个有色成分即将滴出时(前面部分的溶液是没有色素的,可以回收使用),另取一洁净的烧杯收集,得黄色溶液,即胡萝卜素。继续洗脱可得到第二色带的黄绿色溶液,即叶黄素。继续洗脱,可以得到第三个和第四个色带。
【实验流程】
五、注意事项
1、选材时要注意选取新鲜、颜色深的叶片。
2、萃取时不要剧烈振荡,以防止发生乳化现象。
3、为了保持柱子的均一性,使整个吸附剂浸泡在溶剂或溶液中是必要的,否则当柱中溶剂或溶液流干时,就会使柱身干裂,影响渗透和显色的均一性。因此要保证整个装样过程中溶剂要高于硅胶的表面。
4、层析柱填装紧密与否,对分离效果很有影响,若各部分松紧不匀,会影响渗透速度和显色的均匀。