第十四章 过渡元素(二)
本章我们主要了解铜族元素的通性。了解铜的氧化物、氢化物、重要铜盐的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化,铜的配合物。 熟悉银的氧化物、氢氧化物的性质,银的重要配合物。了解锌族元素的通性。掌握氢氧化锌的性质、水溶液中Zn2+的重要反应、锌的重要配合物。熟悉锌、镉、汞的氧化物,镉、汞的氢氧化物的性质,Hg(Ⅰ)和Hg(Ⅱ)间的相互转化,镉、汞的配合物。
§14.1 铜族元素
14.1.1 铜族元素简介
周期系第ⅠB元素,包括铜(Cu)、银(Ag)、金(Au)3种元素,通常称为铜族元素。价电子构型为(n-1)d10ns1。
在自然界中,铜族元素除了以矿物形式存在外,还以单质形式存在。常见的矿物有辉铜矿(Cu2S)、孔雀石[Cu2(OH)2CO4]、辉银矿(Ag2S)、碲金矿(AuTe2)等。
14.1.2 铜族元素的单质
1.物理性质
★ 铜、银、金都有特征颜色:Cu(紫红)、Ag(白)、Au(黄)。
★ 铜、银、金的熔沸点不太高。
★ 它们的导电性、导热性、延展性特别突出。它们的导电性顺序为:Ag>Cu>Au。由于铜的价格较低,所以,铜在电器工业上得到了广泛的应用。
⒉化学性质
铜、银、金的化学活泼性较差,在室温下看不出它们与氧或水作用。在含有CO2的潮湿空气中,铜的表面会逐渐蒙上绿色的铜锈(铜绿—碳酸羟铜Cu2(OH)2CO3)。
2Cu + O2 + H2O + CO2 → Cu2(OH)2CO3
在加热条件下,铜与氧化合成CuO,而银、金不发生变化。此所谓“真金不怕火炼”!
注意:当沉淀剂或配合剂存在时,铜、银、金也可与氧发生作用:
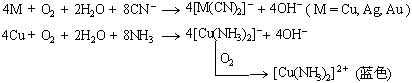
14.1.3 铜族元素的化合物
⒈铜的化合物
铜的常见化合物的氧化值为+1和+2。Cu(Ⅰ)为d10构型,没有d—d跃迁,Cu(Ⅰ)的化合物一般是白色或无色的。Cu(Ⅱ)为d9构型,它们的化合物中常因Cu2+发生d—d跃迁而呈现颜色。
★ 一般说来,在高温、固态时,Cu(Ⅰ)的化合物比Cu(Ⅱ)的化合物稳定,例如:
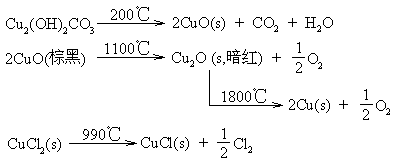
★ 在水溶液中,Cu(Ⅰ)易被氧化为Cu(Ⅱ),水溶液中Cu(Ⅱ)的化合物较稳定。
★ Cu(Ⅰ)的化合物都难溶于水,常见的Cu(Ⅰ)化合物在水中的溶解度顺序为:
CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S
Cu(Ⅱ)的化合物易溶于水的较多。
常见的五水硫酸铜(CuSO4·5H2O)俗称胆矾,晶体呈蓝色,完全脱水后变为白色粉末CuSO4
![]()
无水CuSO4易吸水,吸水后呈蓝色,常被用来鉴定液态有机物中的微量水。工业上常用硫酸铜作为电解铜的原料。在农业上,用它与石灰乳的混合液来消灭果树上的害虫。
⒉银、金的化合物
在银的化合物中,Ag(Ⅰ)的化合物最稳定,而金则以Au(Ⅲ)的化合物较为常见,但在水溶液中多以配合物形式存在。
银的化合物具有以下特点:
★ 难溶的多。
易溶:AgNO3, AgF, AgClO4
难溶:AgCl, AgBr, AgI, AgCN, AgSCN, Ag2S, Ag2CO3, Ag2CrO4等。
★ 热稳定性差(见光,受热易分解)。
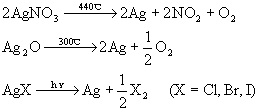
★ 有颜色。
AgCl AgBr AgI Ag2O Ag2CrO4 Ag2S
白 浅黄 黄 褐 砖红 黑
14.1.4 水溶液中铜族元素的离子及其反应
⒈Cu(Ⅱ)、Cu(Ⅰ)离子的反应
★ [Cu(H2O)6]2+呈蓝色,水解程度小。
![]()
OH-(适量) OH-(过量)
Cu2+ ![]() Cu (OH)2(浅蓝)
Cu (OH)2(浅蓝) ![]() Cu (OH)4
Cu (OH)4
| |
|
|
![]() 80~90℃
80~90℃
CuO
![]() 与葡萄糖在加热条件下反应,有暗红色的Cu2O沉淀析出:
与葡萄糖在加热条件下反应,有暗红色的Cu2O沉淀析出:
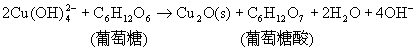
这一反应在有机化学中用来检验某些糖的存在。
★ [Cu(H2O)6]+是无色的,水溶液中很不稳定,容易歧化为Cu2+和Cu:
![]()
例如: Cu2O + H2SO4 → CuSO4 + Cu + H2O
所以在水溶液中Cu(Ⅱ)比Cu(Ⅰ)稳定。
★ 有配合剂、沉淀剂存在时,Cu(Ⅰ)的稳定性提高。
Cu2O + 2HCl → 2CuCl(s) + H2O
Cu2+ + 4Cl- + Cu → 2[CuCl2]-(泥黄素)
所以,常利用CuSO4或CuCl2溶液与浓盐酸和铜屑混合,在加热条件下制取[CuCl2]-溶液。
★ Cu2+具有一定的氧化性:
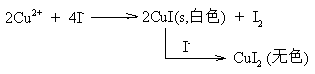
思考:如何鉴定溶液中是否存在Cu2+?
★ Cu(Ⅰ)的配合物多位2配位的,其稳定性顺序为:
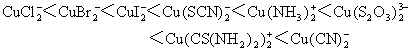
Cu(Ⅱ)的配合物多位4配位的,例如:
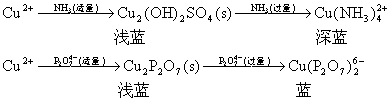
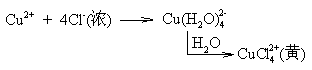
CuSO4·5H2O也是配合物,即[Cu(H2O)4]SO4·H2O
⒉Ag(Ⅰ)离子的反应
★ 一般认为水合银离子的化学式是[Ag(H2O)4]+,它在水中几乎不水解。AgNO3的水溶液呈中性。在Ag+中加入NaOH溶液,因为AgOH极不稳定,析出的沉淀是Ag2O:
2Ag+ + 2OH- → Ag2O(s) + H2O
★ Ag(Ⅰ)的许多化合物都是难溶于水的,在Ag+的溶液中加入配位剂时,常常先的生成难溶化合物,当配位剂过量时,难溶化合物溶解生成配离子。例如:
![]()
含有[Ag(NH3)2]+的溶液能把醛或某些糖氧化,本身被还原为单质银。
2[Ag(NH3)2]+ + HCHO + 3OH- → 2Ag(s) + HCOO- + 4NH3 + 2H2O
这类反应也叫做银镜反应,工业上利用这类反应来制作镜子或在暖水瓶的夹层内镀银。
又如:Ag+与 ![]() 或
或 ![]() 反应都生成Ag2CrO4,Ag2CrO4可溶于足量的氨水中:
反应都生成Ag2CrO4,Ag2CrO4可溶于足量的氨水中:
![]()
该性质用于Ba2+和Ag+的分离。(请注意如何具体操作?)
Ag+与少量Na2S2O3溶液反应生成Ag2S2O3白色沉淀,放置一段时间之后,沉淀由白色转变为黄色、棕色最后为黑色Ag2S。
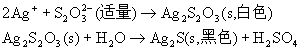
当Na2S2O3过量时,Ag2S2O3溶解,生成配离子[Ag(S2O3)2]3-:
![]()
Ag2S的溶解度很小,难以借配位反应使它溶解,一般采用HNO3的氧化性来实现Ag2S溶解:
![]()
概括以上水溶液中Ag+离子的性质,可通过以下"Ag+序"作简单小结:
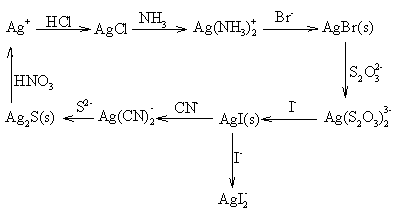
★ Ag+的鉴定。
在Ag+的鉴定实验中,加入HCl有白色沉淀生成仅说明可能有Ag+,必须作进一步的鉴定。即加入NH3·H2O沉淀溶解,将该溶液酸化,有白色沉淀产生或在溶液中加入KI,有黄色沉淀产生,才能证明原始溶液中确实存在Ag+。图示如下:
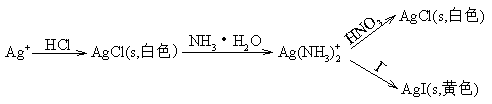
主要反应有:
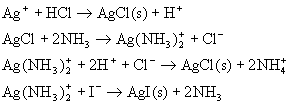
§14.2 锌族元素
14.2.1 锌族元素简介
周期系第ⅡB元素,包括锌(Zn)、镉(Cd)、汞(Hg)3种元素,通常称为锌族元素。它们是与p区元素相邻的d区元素,具有与d区元素相似的性质,如易于形成配合物等。在某些性质上它们又与第四、五、六周期的p区金属元素有些相似,如熔点低,水合离子都无色等。锌族元素一般以矿物形式存在,例如闪锌矿(ZnS)、砂(HgS)等。
14.2.2 锌族元素的单质
1.物理性质
★ 锌、镉、汞都是银白色金属(锌略带蓝色)。
★ 它们都是低熔点金属,特别是汞,它是室温下唯一的液态金属。
★ 易形成合金,例如黄铜Cu—Zn;汞齐Na—Hg,Au—Hg,Ag—Hg。
在0℃~200℃之间,汞的膨胀系数随着温度升高而均匀地改变,并且不润湿玻璃,在制造温度计时常利用汞的这一性质。另外也用汞填充在气压计中。钠汞齐在有机合成中用作温和的还原剂,金汞齐、银汞齐用于提纯贵金属。
⒉化学性质
★ 与氧的作用。
锌、镉、汞在干燥的空气中都是稳定的。在有CO2存在的潮湿空气中,锌的表面常生成一层碱式碳酸盐的薄膜,保护锌不被继续氧化。
4Zn + 2O2 + CO2 + 3H2 → ZnCO3·3Zn(OH)2(碱式碳酸锌)
在空气中加热锌、镉、汞都能形成相应的氧化物。
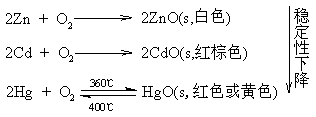
★ 与硫等非金属的作用。
锌、镉、汞均能与硫粉作用,生成相应的硫化物。特别是汞,在室温下就可以与硫粉作用,生成HgS。所以可以把硫粉撒在有汞的地方,防止有毒的汞蒸气进入空气中。若空气中已有汞蒸气,可以把碘升华为气体,使汞蒸气与碘蒸气相遇,生成HgI2,以出去空气中的贡蒸气。
★ 与酸反应。
锌、镉能从稀酸中置换出氢气。汞能与硝酸反应而溶解。
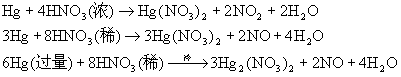
★ 锌与OH-,NH3反应。
锌可以从碱溶液中置换出氢气。
![]()
14.2.3 锌族元素的化合物
锌、镉、汞的价电子构型为(n-1)d10ns2。所以锌和汞通常形成氧化值为+2的化合物,汞除了形成氧化值为+2的化合物外,还有氧化值为+1( ![]() )的化合物。锌和镉的化合物具有大多数无机盐的一般通性,此处就重点讨论汞的化合物。
)的化合物。锌和镉的化合物具有大多数无机盐的一般通性,此处就重点讨论汞的化合物。
★ 汞的卤化物。
氯化汞(HgCl2也称升汞),是直线型共价分子,易升华,微溶于水,在水溶液中主要以分子形式存在,剧毒。
氯化亚汞(Hg2Cl2也称甘汞),也是直线型分子(Cl—Hg—Hg—Cl),有甜味,难溶于水,无毒。
HgBr2,HgI2同HgCl2,但HgF2为离子型化合物。
★ 汞的硝酸盐。
硝酸汞Hg(NO3)2和硝酸亚汞Hg2(NO3)2是离子型化合物,易溶于水。Hg(NO3)2可用HgO或Hg硝酸作用制取:
HgO + 2HNO3 → Hg(NO3)2 + H2O
Hg + 4HNO3(浓) → Hg(NO3)2 + 2NO2 + 2H2O
硝酸汞Hg(NO3)2与Hg作用可制取Hg2(NO3)2:
Hg(NO3)2 + Hg → Hg2(NO3)2
由电势图分析:
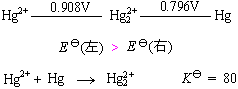
![]() 不发生歧化。
不发生歧化。
14.2.4 水溶液中锌族元素的离子及其性质
1.Zn2+,Cd2+离子的反应
★ 水解反应:
[Zn(H2O)6]2+和[Cd(H2O)6]2+的水解趋势都较弱:
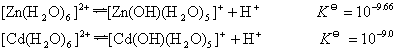
★ 沉淀反应:
在Zn2+,Cd2+的溶液中加入强碱,都生成氢氧化物,但Zn(OH)2是两性,而Cd(OH)2是碱性的。
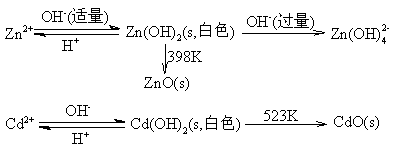
在Zn2+,Cd2+的溶液中分别通入H2S时,都会有硫化物从溶液中沉淀出来:
Zn2+ + H2S → ZnS(s,白色) + 2H+
Cd2+ + H2S → CdS(s,黄色) + 2H+
注意:Zn2+只有在氨碱性条件下才能沉淀完全。CdS的黄色可作为鉴定Cd2+的特征颜色。
在ZnSO4溶液中加入BaS时,生成ZnS和BaSO4的混合沉淀物:
![]()
此沉淀叫做锌钡白,俗称立德粉,是一种较好的白色颜料,没有毒性,在空气中比较稳定。
★ 在Zn2+,Cd2+的溶液中分别加入NH3·H2O,均生成氢氧化物沉淀,当NH3·H2O过量后生成氨的配物:
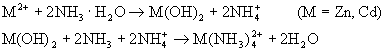
在水溶液中,Zn2+和Cd2+与同种配体形成的两种配合物相比,一般说来后者较稳定。
★ Zn2+的鉴定
在碱性条件下,Zn2+与二苯硫腙反应,生成粉红色的内配盐沉淀:
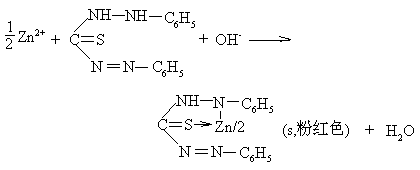
此内配盐能溶于CCl4中,呈棕色。实验现象为:绿色的二苯硫腙四氯化碳溶液与Zn2+反应后充分振荡,静置,上层为粉红色,下层为棕色。
⒉Hg(Ⅰ),Hg(Ⅱ)离子的反应
★ 水解反应
在Hg(NO3)2和Hg2(NO3)2的酸性溶液中,分别有无色的[Hg(H2O)6]2+和[Hg2(H2O)x]2+存在,它们按下式水解:
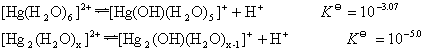
增大溶液的酸性可抑制它们的水解。
★ 沉淀反应。在Hg2+和 ![]() 的溶液中加入强碱时,分别生成黄色HgO和棕色Hg2O沉淀
的溶液中加入强碱时,分别生成黄色HgO和棕色Hg2O沉淀
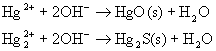
Hg2O很快分解为HgO和Hg。
Hg2O → HgO + Hg
思考:到目前为止,我们学过哪些阳离子与碱作用后生成氧化物而不生成氢氧化物。为什么?
★ 在Hg2+, ![]() 的溶液中分别加入适量的Br-,I-,
的溶液中分别加入适量的Br-,I-, ![]() ,CN-和S2-时,分别生成难溶于水的汞盐和亚汞盐。但许多难溶于水的亚汞盐见光受热容易歧化为相应的汞盐和单质汞(除Hg2Cl2)。例如:汞盐可溶于过量的阳离子溶液形成配合物。
,CN-和S2-时,分别生成难溶于水的汞盐和亚汞盐。但许多难溶于水的亚汞盐见光受热容易歧化为相应的汞盐和单质汞(除Hg2Cl2)。例如:汞盐可溶于过量的阳离子溶液形成配合物。

HgI2可溶于过量的KI溶液中:
![]()
在HgCl2溶液中通入H2S时,会析出HgS沉淀:例如:汞盐可溶于过量的阳离子溶液形成配合物。
![]()
HgS难溶于盐酸或硝酸中,但能溶于过量的浓的Na2S溶液中:
![]()
实验室常用王水来溶解HgS:
![]()
★ Hg(Ⅰ),Hg(Ⅱ)与NH3·H2O反应先生成NH2HgCl白色沉淀,当有过量的NH4Cl存在时才与NH3形成配合物:
HgCl2 + 2NH3 → NH2HgCl(s) + NH4Cl
Hg2Cl2 + 2NH3 → NH2Hg2Cl(s) + NH4Cl
NH2Hg2Cl → NH2HgCl + Hg
NH2HgCl + 2NH3 + NH4Cl → [Hg(NH3)4]Cl2
★ Hg2+的鉴定。
利用Sn2+的还原性,鉴定Hg2+的存在。
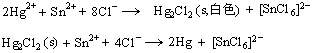
溶液由白→黑灰→黑色。利用该原理,也可用HgCl2鉴定Sn2+。
思考:利用图示法总结锌、镉、汞的重要性质
14.2 锌族元素
14.2.1 锌族元素简介
周期系第ⅡB元素,包括锌(Zn)、镉(Cd)、汞(Hg)3种元素,通常称为锌族元素。它们是与p区元素相邻的d区元素,具有与d区元素相似的性质,如易于形成配合物等。在某些性质上它们又与第四、五、六周期的p区金属元素有些相似,如熔点低,水合离子都无色等。锌族元素一般以矿物形式存在,例如闪锌矿(ZnS)、砂(HgS)等。
14.2.2 锌族元素的单质
1.物理性质
锌、镉、汞都是银白色金属(锌略带蓝色)。
它们都是低熔点金属,特别是汞,它是室温下唯一的液态金属。
易形成合金,例如黄铜Cu—Zn;汞齐Na—Hg,Au—Hg,Ag—Hg。
在0℃~200℃之间,汞的膨胀系数随着温度升高而均匀地改变,并且不润湿玻璃,在制造温度计时常利用汞的这一性质。另外也用汞填充在气压计中。钠汞齐在有机合成中用作温和的还原剂,金汞齐、银汞齐用于提纯贵金属。
⒉化学性质
与氧的作用。
锌、镉、汞在干燥的空气中都是稳定的。在有CO2存在的潮湿空气中,锌的表面常生成一层碱式碳酸盐的薄膜,保护锌不被继续氧化。
4Zn + 2O2 + CO2 + 3H2 → ZnCO3·3Zn(OH)2(碱式碳酸锌)
在空气中加热锌、镉、汞都能形成相应的氧化物。
与硫等非金属的作用。
锌、镉、汞均能与硫粉作用,生成相应的硫化物。特别是汞,在室温下就可以与硫粉作用,生成HgS。所以可以把硫粉撒在有汞的地方,防止有毒的汞蒸气进入空气中。若空气中已有汞蒸气,可以把碘升华为气体,使汞蒸气与碘蒸气相遇,生成HgI2,以出去空气中的贡蒸气。
与酸反应。
锌、镉能从稀酸中置换出氢气。汞能与硝酸反应而溶解。
锌与OH-,NH3反应。
锌可以从碱溶液中置换出氢气。
14.2.3 锌族元素的化合物
锌、镉、汞的价电子构型为(n-1)d10ns2。所以锌和汞通常形成氧化值为+2的化合物,汞除了形成氧化值为+2的化合物外,还有氧化值为+1( ![]() )的化合物。锌和镉的化合物具有大多数无机盐的一般通性,此处就重点讨论汞的化合物。
)的化合物。锌和镉的化合物具有大多数无机盐的一般通性,此处就重点讨论汞的化合物。
汞的卤化物。
氯化汞(HgCl2也称升汞),是直线型共价分子,易升华,微溶于水,在水溶液中主要以分子形式存在,剧毒。
氯化亚汞(Hg2Cl2也称甘汞),也是直线型分子(Cl—Hg—Hg—Cl),有甜味,难溶于水,无毒。
HgBr2,HgI2同HgCl2,但HgF2为离子型化合物。
汞的硝酸盐。
硝酸汞Hg(NO3)2和硝酸亚汞Hg2(NO3)2是离子型化合物,易溶于水。Hg(NO3)2可用HgO或Hg硝酸作用制取:
HgO + 2HNO3 → Hg(NO3)2 + H2O
Hg + 4HNO3(浓) → Hg(NO3)2 + 2NO2 + 2H2O
硝酸汞Hg(NO3)2与Hg作用可制取Hg2(NO3)2:
Hg(NO3)2 + Hg → Hg2(NO3)2
由电势图分析:
![]() 不发生歧化。
不发生歧化。
14.2.4 水溶液中锌族元素的离子及其性质
1.Zn2+,Cd2+离子的反应
水解反应:
[Zn(H2O)6]2+和[Cd(H2O)6]2+的水解趋势都较弱:
沉淀反应:
在Zn2+,Cd2+的溶液中加入强碱,都生成氢氧化物,但Zn(OH)2是两性,而Cd(OH)2是碱性的。
在Zn2+,Cd2+的溶液中分别通入H2S时,都会有硫化物从溶液中沉淀出来:
Zn2+ + H2S → ZnS(s,白色) + 2H+
Cd2+ + H2S → CdS(s,黄色) + 2H+
注意:Zn2+只有在氨碱性条件下才能沉淀完全。CdS的黄色可作为鉴定Cd2+的特征颜色。
在ZnSO4溶液中加入BaS时,生成ZnS和BaSO4的混合沉淀物:
![]()
此沉淀叫做锌钡白,俗称立德粉,是一种较好的白色颜料,没有毒性,在空气中比较稳定。
在Zn2+,Cd2+的溶液中分别加入NH3·H2O,均生成氢氧化物沉淀,当NH3·H2O过量后生成氨的配物:
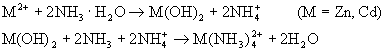
在水溶液中,Zn2+和Cd2+与同种配体形成的两种配合物相比,一般说来后者较稳定。
Zn2+的鉴定
在碱性条件下,Zn2+与二苯硫腙反应,生成粉红色的内配盐沉淀:
此内配盐能溶于CCl4中,呈棕色。实验现象为:绿色的二苯硫腙四氯化碳溶液与Zn2+反应后充分振荡,静置,上层为粉红色,下层为棕色。
⒉Hg(Ⅰ),Hg(Ⅱ)离子的反应
水解反应
在Hg(NO3)2和Hg2(NO3)2的酸性溶液中,分别有无色的[Hg(H2O)6]2+和[Hg2(H2O)x]2+存在,它们按下式水
增大溶液的酸性可抑制它们的水解。
沉淀反应。在Hg2+和 ![]() 的溶液中加入强碱时,分别生成黄色HgO和棕色Hg2O沉淀
的溶液中加入强碱时,分别生成黄色HgO和棕色Hg2O沉淀
Hg2O很快分解为HgO和Hg。
Hg2O → HgO + Hg
思考:到目前为止,我们学过哪些阳离子与碱作用后生成氧化物而不生成氢氧化物。为什么?
在Hg2+, ![]() 的溶液中分别加入适量的Br-,I-,
的溶液中分别加入适量的Br-,I-, ![]() ,CN-和S2-时,分别生成难溶于水的汞盐和亚汞盐。但许多难溶于水的亚汞盐见光受热容易歧化为相应的汞盐和单质汞(除Hg2Cl2)。例如:汞盐可溶于过量的阳离子溶液形成配合物。
,CN-和S2-时,分别生成难溶于水的汞盐和亚汞盐。但许多难溶于水的亚汞盐见光受热容易歧化为相应的汞盐和单质汞(除Hg2Cl2)。例如:汞盐可溶于过量的阳离子溶液形成配合物。

HgI2可溶于过量的KI溶液中:
![]()
在HgCl2溶液中通入H2S时,会析出HgS沉淀:例如:汞盐可溶于过量的阳离子溶液形成配合物。
![]()
HgS难溶于盐酸或硝酸中,但能溶于过量的浓的Na2S溶液中:
![]()
实验室常用王水来溶解HgS:
![]()
Hg(Ⅰ),Hg(Ⅱ)与NH3·H2O反应先生成NH2HgCl白色沉淀,当有过量的NH4Cl存在时才与NH3形成配合物:
HgCl2 + 2NH3 → NH2HgCl(s) + NH4Cl
Hg2Cl2 + 2NH3 → NH2H2Cl(s) + NH4Cl
NH2Hg2Cl → NH2HgCl + Hg
NH2HgCl + 2NH3 + NH4Cl → [Hg(NH3)4]Cl2
Hg2+的鉴定。
利用Sn2+的还原性,鉴定Hg2+的存在。
溶液由白→黑灰→黑色。利用该原理,也可用HgCl2鉴定Sn2+。
思考:利用图示法总结锌、镉、汞的重要性质
1 / 12