第十三章 过渡元素(一)
本章我们主要了解过渡元素的通性。了解钛、钒及其重要化合物的性质。 熟悉铬的电势图,掌握 Cr(Ⅲ ),Cr( Ⅵ)化合物的酸碱性、氧化还原性及其相互转化。了解钼钨的化合物。 熟悉锰的电势图,掌握 Mn(Ⅱ ),Mn( Ⅳ),Mn(Ⅵ),Mn(Ⅶ)的重要化合物的性质和反应。掌握Fe(Ⅱ ),Co( Ⅱ),Ni(Ⅱ)的重要化合物的性质及其变化规律;掌握 Fe(Ⅲ ),Co( Ⅲ),Ni(Ⅲ)的重要化合物的性质及其变化规律。熟悉铁、钴、镍的重要配合物。
§13.1 d区元素概述
13.1.1 d区元素简介
d区元素包括周期系第ⅢB~Ⅶ B,Ⅶ,Ⅰ B~ⅡB元素,不包括镧系和锕系元素。 d区元素都是金属元素。d区元素的价电子构型为,(n-1)d1-10ns1-2(Pd为5s0)。同周期d区元素金属性递变不明显,通常按不同周期将过渡元素分为三个过渡系:
第一过渡系:第四周期元素从钪(Sc)到锌Zn;
第二过渡系:第五周期元素从钇(Y)到镉(Cd);
第三过渡系:第六周期元素从镥(Lu)到汞(Hg)。
d区元素在自然界中储量以第一过渡系为较多,它们的单质和化合物在工业上的用途也较广泛。本章将重点学习从钛(Ti)到镍(Ni)这7个元素,还要适当了解我国的丰产元素钼 (Mo)和钨(W)。
13.1.2 d区元素的原子半径和电离能
同周期过渡元素的原子半径随着原子序数的增加而缓慢地依次减小,到了第Ⅷ族元素后又缓慢增大。同族过渡元素的原子半径,除了ⅢB外,自上而下随着原子序数的增大而增大。
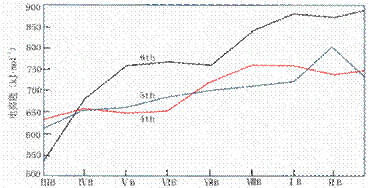
各过渡系元素电离能随原子序数的增大,总的变化趋势是逐渐增大的。同副族过渡元素的电离能递变不很规则。d区元素的第一电离能变化趋势如图所示。
13.1.3 d区元素的物理性质
★ 熔点、沸点高。熔点最高的单质是钨(W)
★ 硬度大。硬度最大的金属是铬(Cr)
★ 密度大。密度最大的单质是锇(Os)
★ 导电性、导热性、延展性好。
13.1.4 d区元素的化学性质
在化学性质方面,第一过渡系元素的单质比第二、三过渡系元素的单质活泼。化学性质变化总趋势是同一过渡系单质的活泼性从左到右降低。
13.1.5 d区元素的氧化态
过渡元素大多可以形成多种氧化值的化合物。图中给出了第一过渡系元素的各种氧化值,红色代表常见的氧化值

13.1.6 d区元素的离子的颜色
过渡元素的水合离子大多是有颜色的。
过渡元素与其它配体形成的配离子也常具有颜色。这些配离子吸收了可见光(>30nm~ 400nm)的一部分发生了d—d跃迁,而把其余部分的光透过或散射出来,我们看到的物质的颜色就是这部分透射光或散射光。
对于某些具有颜色的含氧酸根离子,如 (黄色), (紫色)等,它们的颜色被认为是由电荷迁移引起的。
§13.2.钛副族 Ti, Zr, Hf
一.钛的存在与冶炼
- 稀有元素
Ti属于稀有元素,Ti有富矿红金石(TiO2)和钛铁矿(FeTiO3),在地壳中含量为0.42%, 居第10位。
Zr 以锆石等形式存在, 居20位, 比熟知的Cu和Zn都多。
2. 钛的冶炼
工业上以钛铁矿为原料,制取钛单质。
![]()
先用浓H2SO4处理磨碎的钛铁矿粉:
FeTiO3 + 3H2SO4 ===Ti(SO4)2 + FeSO4 + 3H2O
矿石中的FeO和Fe2O3也同时转变成了硫酸盐,加入Fe粉,还原Fe2(SO4)3至FeSO4,冷却使FeSO4·7H2O(绿矾)结晶,得副产品。
水解Ti(SO4)2:
Ti(SO4)2 + H2O=== TiOSO4(硫酸氧钛) + H2SO4
TiOSO4 + 2H2O ===H2TiO3(沉淀白色,偏钛酸) + H2SO4
煅烧H2TiO3制得TiO2
H2TiO3 ![]() TiO2 + H2O
TiO2 + H2O
氯化、耦合制TiCl4
TiO2 + 2C + 2Cl2 ![]() TiCl4(l) + 2CO(气体)
TiCl4(l) + 2CO(气体)
在Ar气氛保护下,用熔镁还原TiCl4蒸气
TiCl4(g) + 2Mg(l) --- Ti + 2MgCl2(l) (熔融, Ar气保护)
可以将剩余的Mg和生成的MgCl2蒸发掉,或用盐酸将Mg和MgCl2溶掉,得海绵钛再熔炼,得Ti单质。 也可直接氯化金红石矿粉,制TiCl4,完成钛的冶炼。
二 钛单质
1. 物理性质
银白色,密度4.54,比钢铁的7.8小,比铝的2.7大,较轻,强度接近钢铁,兼有铝铁的优点,既轻强度又高(航天材料, 眼镜架等)。
制作记忆性合金NT合金(镍钛合金, NT),
亲生物性,人造骨, 可与生物体骨肉易长在一起。
- 化学性质

热力学上很活泼,但表面钝化,在常温下极稳定。常温不与X2、O2、H2O反应,不与强酸(包括王水),以及强碱反应。钛合金耐酸碱腐蚀。但高温时钛相当活泼:
Ti + O2 === TiO2 (红热)
Ti + 2Cl2 === TiCl4 (600K)
3Ti + 2N2 === Ti3N4 (800K)
Ti的以上反应均达到最高氧化态。
2Ti + 6HCl ==2TiCl3(紫色) + 3H2(气体)
最好的溶剂是氢氟酸或氢氟酸与盐酸的混合液,产生![]() :
:
Ti + 6HF ===TiF62- + 2H+ + 2H2(气体)
Ti不溶于热碱,但和熔融碱作用:
2Ti + 6KOH ====2K3TiO3 + 3H2 (熔融)
总之, 钛密度小,强度高,抗酸碱腐蚀,有记忆性,亲生物性,在地壳中储量高,是极有前途的结构材料,被誉为“第三金属”和“二十一世纪金属”。
三 钛的重要化合物
1. 二氧化钛
1°与酸的作用
TiO2白色粉末,俗称钛白,不溶于H2O、稀酸和稀碱中,在一定的条件下可溶于热浓H2SO4中。
TiO2 + 2H2SO4(浓) ![]() Ti(SO4)2 + 2H2O
Ti(SO4)2 + 2H2O
![]() 电场过强,在水中易水解成:
电场过强,在水中易水解成:
![]()
![]() 称为钛氧基或钛酰基,因此上述反应可写成:
称为钛氧基或钛酰基,因此上述反应可写成:
TiO2 + H2SO4(浓) ![]() TiOSO4 + H2O
TiOSO4 + H2O
![]() 和
和![]() 之间有如下平衡:
之间有如下平衡:
![]()
水溶液中不能析出 Ti(SO4)2,却可以析出白色粉末TiOSO4·H2O。
TiO2与KHSO4共熔,得可溶性盐类:
TiO2 + 2KHSO4 ===TiOSO4 + K2SO4 + H2O (熔融)
2°与碱性化合物作用
TiO2 + MgO=== MgTiO3 (熔融)
TiO2 + BaCO3=== BaTiO3 + CO2(气体) (熔融)
BaTiO3,偏钛酸钡,是一种压电材料,受压时两端产生电位差。
2. 钛酸
在钛盐中加碱,可得![]() -钛酸(氢氧化钛):
-钛酸(氢氧化钛):
TiBr4 + 4NaOH === Ti(OH)4(沉淀) + 4NaBr![]() -钛酸活性大,可溶于酸或碱,可以写成Ti(OH)4、H4TiO4或TiO2·xH2O等形式。
-钛酸活性大,可溶于酸或碱,可以写成Ti(OH)4、H4TiO4或TiO2·xH2O等形式。
将钛酸溶液煮沸,水解生成![]() -钛酸,这种水解即使加强酸也不能抑制。
-钛酸,这种水解即使加强酸也不能抑制。
Ti(SO4)2 + 4H2O![]() Ti(OH)4 + 2H2SO4
Ti(OH)4 + 2H2SO4
得到的![]() -钛酸稳定,不溶于酸也不溶于碱。
-钛酸稳定,不溶于酸也不溶于碱。
3. 四氯化钛
TiCl4无色溶液,有刺激性气味,极易水解,在空气中冒白烟
TiCl4 + H2O === H2TiO3 + 4HCl
制TiCl4关键是防止水解。
4. 三氯化钛
单质钛在加热情况下与盐酸反应得TiCl3紫色溶液。
TiCl3也可以由TiCl4还原制得:
2TiCl4 + H2 ===TiCl3 + 2HCl
2TiCl4 + Zn === TiCl3 + ZnCl2
从水溶液中可以析出TiCl3·6H2O的紫色晶体,配合物的构成是[Ti(H2O)6]Cl3。 若用乙醚从TiCl3的饱和溶液中萃取出,可得TiCl3 ·6H2O绿色晶体,配合物的构成是[Ti(H2O)5Cl]Cl2·H2O。两者互为水合异构。
有关Ti(IV)和Ti(III)的电极电势如下:
![]()
可见说不上Ti(IV)的氧化性,倒可谈Ti(III)的还原性
![]()
![]()
四 锆与铪
由于镧系收缩的影响,Zr 与Hf 极为相似,均为浅灰色和灰色金属。元素 Zr 发现后,大约 30 年以后发现 Hf,并发现 30 年来对Zr 进行的研究,全是在含 2% Hf 的基础上完成的。
Zr 和 Hf 耐酸性比 Ti 还强,尤其是 Hf,100℃ 以下对酸稳定(HF 除外 ),与碱可反应:
Zr + 4KOH === K4ZrO4 + 2H2(气体)
ZrO2 是白色粉末,硬度高,高温处理的 ZrO2, 除 HF 外, 不溶于其它酸。 常用的可溶性锆是 ZrOCl2,易水解
ZrOCl2 + (x+1)H2O === ZrO2·xH2O(锆酸) + 2HCl
锆酸比钛酸弱,也有两性。
§13.2.钒副族
一.钒单质
钒在自然界中非常分散,V(III)经常和铁矿混生,如钒钛铁矿,V(V)尚可独立成矿,钒是稀有金属。
钒浅灰色,高熔点(比Ti高),纯净时延展性好,不纯时硬而脆。钢中加0.1- 0.2%的钒,韧性、强度、延展性及抗冲击力均加强。
![]()
热力学上看,应是极活泼的金属,但由于表面钝化,常温下不活泼,块状的钒可以抵抗空气的氧化和海水的腐蚀,非氧化性酸及碱也不能与钒作用。
V可以溶于浓硫酸和硝酸中
V + 8HNO3 == V(NO3)4 + 4NO2 + 4H2O
V(NO3)4 或以VO(NO3)2形式存在。
高温下活性很高
2V + 5O2 ===V2O5 (砖红色固体)
V + 2Cl2 === VCl4 (红色液体)
V可以与熔融的强碱反应。
二 钒的重要化合物
1. 五氧化二钒
V2O5 , 砖红色固体,无臭、无味、有毒,是钒酸 H3VO4 及偏钒酸 HVO3 的酸酐。 加热偏钒酸铵可得V2O5
2NH4VO3 === V2O5 + 2NH3 + H2O
三氯氧钒水解也得V2O5
2VOCl3 + 3H2O ===V2O5 + 6HCl
V2O5 在H2O中溶解度很小,但在酸中、碱中都可溶,是两性氧化物。
V2O5 + 6NaOH === 2Na3VO4 + 3H2O
V2O5 + H2SO4 === (VO2)2SO4 + H2O
和盐酸的反应,放出Cl2,V2O5有氧化性
V2O5 + 6HCl === 2VOCl2 + Cl2 + 3H2O
2. 钒酸盐
偏钒酸盐VO3ˉ,正钒酸盐VO43ˉ,二聚钒酸盐V2O74ˉ,多聚酸(Hn+2VnO3n+1).
存在形式与体系的pH值有关,pH越大聚合度越低,pH越小,聚合度越高。
(1) 当pH>13时,以VO43ˉ存在,pH降低,经二聚,四聚、五聚.....逐渐升高;
(2) 当pH=2时,以V2O5形式析出;
(3) 当pH≤1时,以阳离子存在![]() . (V2O5与强酸的反应产物)
. (V2O5与强酸的反应产物)
3. 各种氧化态的钒离子

三 铌和钽
Nb浅灰色,Ta银白色,性质十分相似。Nb、Ta在室温下活性很低,尤其是Ta,甚至不和王水反应。但可以缓慢地溶于氢氟酸,尤其是HF-HNO3的混酸中。 在空气中加热均可得五价的氧化物:
4Nb + 5O2 ![]() 2Nb2O5
2Nb2O5
4Ta + 5O2 ![]() 2Ta2O5
2Ta2O5
Ta2O5相当稳定,加热至1470℃熔化而不分解,不被H2所还原。
Nb和Ta的含氧酸和钒酸相似,有多酸形式,NbOCl3易水解:
2NbOCl3 + (x+3)H2O=== Nb2O5·xH2O + 6HCl
§13.3 铬 钼 钨 多酸型配合物
周期系第Ⅵ B族元素也叫铬分族,包括铬(Cr)、钼(Mo)、钨(W)3种元素。价电子构型为: (n-1)d4-5ns1-2。在自然界中的主要矿物有铬铁矿(Fe(CrO2)2)、辉钼矿(MoS2)、黑钨矿(MnFeWO4)、白钨矿(CaWO4)。我国钼矿资源丰富,钨矿的储量约占世界储量的一半。
13.3.1 铬 钼 钨的单质
铬、钼、钨都是灰白色金属。它们的熔点和沸点高。在通常条件下,由于铬、钼、钨表面形成一层氧化膜,它们在空气或水中都相当稳定。因此常在铁制品的表面镀有一层铬,可起到防腐、美化的作用。室温下,无保护膜的纯铬能溶于稀盐酸和硫酸溶液中,而不溶于硝酸和磷酸。钼和钨都能溶于硝酸和氢氟酸的混合溶液中。
13.3.2 铬的化合物
铬原子的价电子构型为:3d54s1。铬的最高氧化值为+6。铬也能形成氧化值为+5,+4,+3,+2,+1,0,-1,-2的化合物。铬的重要化合物有:三氧化铬(CrO3)暗红色晶体,铬酸钾(K2CrO4)黄色晶体,重铬酸钾(K2Cr2O7)橙红色晶体,三氧化二铬(Cr2O3)绿色粉末,硫酸钾铬(铬钾钒,(KCr(SO4)2·12H2O)暗紫色晶体。
铬的重要化合物通常以K2Cr2O7为原料制备,而K2Cr2O7是由铬铁矿借助于碱溶法制得的,制备K2Cr2O7的流程图如下:

所涉及到的重要反应为:

13.3.3 水溶液中铬的离子及其反应
1.Cr(Ⅲ)的盐
★ Cr3+在水溶液中发生水解。
![]()
在Cr3+的水溶液中引入弱酸根离子,水解将进行到底。
2Cr3+ + 3S2- + 6H2O → 2Cr(OH)3(s) + 3H2S(g)
2Cr3+ + 3CO32- + 6H2O → 2Cr(OH)3(s) + 3H2S(g)
向Cr3+溶液中加入碱时,先生成灰绿色的 Cr(OH)3沉淀,当碱过量时生成亮绿色的 ![]() 溶液。
溶液。
★ Cr(Ⅲ)具有还原性,但在碱性条件下较强,即:若想将Cr(Ⅲ)氧化为Cr(Ⅵ),选择碱性条件更容易。
![]()
![]()
![]()
★ Cr(Ⅲ)的鉴定:
原理流程:
![]()
重要反应:

在反应最后一步加入乙醚,目的是使CrO(O2)2能够较稳定地存在。
![]()

★ Cr3+有一定的氧化性
2Cr3+(紫色) + Zn(s) → 2Cr2+(蓝色) + Zn2+
★ Cr(Ⅲ)的配合物有多种颜色
[Cr(H2O)6]Cl3紫色, [CrCl(H2O)5]Cl2· H2O蓝绿色, [CrCl2(H2O)4]Cl· H2O绿色。
⒉Cr(Ⅵ)在水溶液中的存在及转化
★ pH值不同,存在形式不同
pH<2,以 ![]() 为主,pH>6,以
为主,pH>6,以 ![]() 为主。二者间存在下列平衡。
为主。二者间存在下列平衡。
![]()
★ 难溶盐的生成使 ![]() 转化为
转化为 ![]()
例如: ![]()
所以 向 ![]() 的溶液中加入Ag+时,生成Ag2CrO4
的溶液中加入Ag+时,生成Ag2CrO4
![]()
同理:
★ ![]() 的氧化性
的氧化性
![]() 有很强的氧化性(
有很强的氧化性( ![]() ),而
),而 ![]() 的氧化性很差。
的氧化性很差。
| Fe2+ | Sn2+ | H2S | I- | Cl-(浓盐酸中) | |
对应产物 | Fe3+ | Sn4+ |
| S | I2 | Cl2 |
例如: ![]()
这一反应在分析化学中常用于Fe2+含量的测定。
⒊小结

13.3.4 钼、钨的化合物
钼和钨的原子价层电子构型分别为:4d55s1和 5d46s2,它们都能形成氧化值从+2到+6的化合物。其中氧化值为+6的化合物较稳定。例如:钼酸铵((NH4)2MoO4),钨酸钠(Na2WO4)等.
★ 碱金属和 ![]() 的钼(Ⅵ)、钨 (Ⅵ)含氧酸盐易溶于水。在可溶性的钨酸盐或钼酸盐中,增加酸度往往形成聚合的酸根离子。在(NH4)2MoO4和Na2WO4的溶液中分别加入适量的盐酸,则析出难溶于水的钼酸H2MoO4和钨酸H2WO4。
的钼(Ⅵ)、钨 (Ⅵ)含氧酸盐易溶于水。在可溶性的钨酸盐或钼酸盐中,增加酸度往往形成聚合的酸根离子。在(NH4)2MoO4和Na2WO4的溶液中分别加入适量的盐酸,则析出难溶于水的钼酸H2MoO4和钨酸H2WO4。
![]()
★ ![]() 和
和 ![]() 可以与H2S作用,生成硫化物。
可以与H2S作用,生成硫化物。

★ MoS3和WS3能溶于(NH4)2S中形成硫代酸盐
![]()
★ 用硝酸酸化的钼酸铵溶液,加热至50℃,再加入Na2HPO4,生成磷钼酸铵(NH4)3PO4·12MoO3· 6H2O黄色沉淀
![]()
这一反应常用来 检查溶液中是否含有 ![]() ,也可用来鉴定溶液中的
,也可用来鉴定溶液中的 ![]() 。
。
13.3.5 多酸型配合物 同多酸和杂多酸及其盐
多酸:由简单含氧酸缩合起来的,含有复杂酸根离子的含氧酸。例如:H2Cr2O7。
从配合物的观点来看,简单的酸根离子 ![]() 也是配离子,形成体是Cr(Ⅵ),配位体是O2-。这类酸根离子为单核配离子。显然,多酸根
也是配离子,形成体是Cr(Ⅵ),配位体是O2-。这类酸根离子为单核配离子。显然,多酸根 ![]() 为多核配离子,结构为:
为多核配离子,结构为:

当形成体是同种离子时,该多酸为同多酸。例如:H2P2O7。
当形成体是不同种离子时,该多酸为杂多酸,对应的盐为杂多酸盐。例如: (NH4)3PO4· 12MO3·6H2O;根据实验测定和配合物的结构理论,把它写为 (NH4)3[P(Mo3O10)4] ·6H2O,其中P(Ⅴ)是形成体,而四个 ![]() 是配位体
是配位体
§13.4 锰
周期系第ⅦB族元素也叫锰族元素,包括锰(Mn)、锝(Te)、铼(Re)3种元素。价电子构型为:(n-1)d5ns2。
锰在地壳中的含量在过渡元素中占第三位,仅次于铁和钛。锰在自然界中主要以软锰矿MnO2·xH2O的形式存在。
16.4.1 锰的单质
锰是白色金属,质硬而脆,外形与铁相似。纯锰用途不大,常以锰铁的形式来制造各种合金钢。
★ 常温下,锰能缓慢地溶于水: Mn + 2H2O → Mn(OH)2(s) + H2
★ 锰能溶于稀酸并放出氢气。
★ 在氧化剂存在下,锰能与熔融的碱作用生成锰酸盐:2Mn + 4KOH + 3O2 → 2K2MnO4 + 2H2O
★ 锰还能与氧、卤素等非金属作用,生成相应的化合物。
13.4.2 锰的化合物
锰原子的价电子构型为3d54s2。锰的最高氧化值为+7。锰也能形成氧化值从+6到-2的化合物。锰的重要化合物有:高锰酸钾(KMnO4)紫黑色晶体,锰酸钾(K2MnO4)暗绿色晶体,二氧化锰(MnO2)黑色粉末,硫酸锰(MnSO4·7H2O)肉红色晶体,氯化锰(MnCl2· 4H2O)肉红色晶体。
以软锰矿为原料,可以制备KMnO4,Mn3O4,MnO等。制备流程图如下:

13.4.3 锰的化合物
⒈Mn(Ⅱ)的性质
★ Mn2+在水溶液中比较稳定,水解程度较小。
![]()
向Mn2+ 的溶液中加入OH-时,先得到白色的Mn(OH)2沉淀。
Mn2+ + 2OH- → Mn(OH)2(s)
Mn(OH)2在空气中很快被氧化成棕色的Mn3O4和 MnO2的水合物
![]()
或 ![]()
★ 在氨碱性条件下,向Mn2+溶液中加入 H2S溶液,生成肉红色的MnS沉淀。该沉淀可溶于醋酸中。
Mn2+ + H2S + 2NH3 → MnS(s,肉色) + 2NH4+
MnS + 2HAC → Mn2+ + H2S + 2AC-
★ Mn2+的还原性差,在酸性介质中要实现 ![]() 的转化需要采用强氧化剂。例如:NaBiO3,PbO2,K2S2O8,H5IO6 等。
的转化需要采用强氧化剂。例如:NaBiO3,PbO2,K2S2O8,H5IO6 等。
![]()
说明:
① 该反应常用来鉴定溶液中微量的Mn2+。若Mn2+存在,则溶液由无色(Mn2+)变为紫红色( ![]() )。
)。
② 酸化时不能用HCl,Cl-会还原 ![]() 而使紫色立即褪去。
而使紫色立即褪去。
③ Mn2+的浓度很低时,很灵敏。当Mn2+过多时也会使紫色立即消失。
![]()
⒉ Mn(Ⅳ)的性质
Mn(Ⅳ)通常以MnO2的形式存在。MnO2通常呈现强氧化性 。
![]()
MnO2也有一定程度的还原性。
MnO2 + 2MnO4- + 4OH- (浓) → 3MnO42- + 2H2O
⒊Mn(Ⅵ)的性质
Mn(Ⅵ)一般以K2MnO4的形式存在。K2MnO4是暗绿色晶体, ![]() 在pH>13.5的强碱性溶液中才能存在,在水溶液或酸性溶液中易歧化:
在pH>13.5的强碱性溶液中才能存在,在水溶液或酸性溶液中易歧化:
![]()
⒋Mn(Ⅶ)的性质
Mn(Ⅶ)通常以KMnO4的形式存在。KMnO4有强氧化性, ![]()
可氧化物质 |
| I- | Cl- | H2S | Fe2+ | Sn2+ |
产物 |
| I2 | Cl2 | S或 | Fe3+ | Sn4+ |
溶液的酸度不同, ![]() 被还原的产物也不同
被还原的产物也不同
★ 酸性条件:
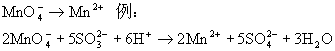
★ 中性条件:

★ 浓强碱性条件条件:

KMnO4 热稳定性差,通常盛装于棕色瓶中。例如:
★ 见光(遇酸): ![]()
★ 浓碱: ![]()
★ 加热: ![]()
★
⒌锰的有关离子和化合物的性质小结

§13.5 铁 钴 镍
周期系第Ⅷ 族元素包括:
铁(Fe) 钴(Co) 镍(Ni) ← 铁系
钌 (Ru) 铑(Rh) 钯 (Pd) ← 铂系
锇 (Os) 铱(Ir) 铂(Pt) ← 铂系
铁系元素中,以铁的分布最广。铁在地壳中的含量居第四位,在金属中仅次于铝。铁的主要矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2)和菱铁矿(FeCO3)等。钴和镍的常见矿物是辉钴矿(CoAsS)和镍黄铁矿(NiS· FeS)。
13.5.1 铁、钴、镍的单质
铁、钴、镍都是银白色金属,能被磁体所吸引,是 铁磁性物质 。
钴、镍和纯铁在空气中都是稳定的,但一般的铁因含有杂质在潮湿的空气中慢慢形成棕色的铁锈Fe2O3·xH2O。
铁、钴、镍都能从稀酸中置换出氢气。 Co,Ni的相应反应要慢一些。
冷的硝酸溶液可使铁、钴、镍变成钝态。浓硫酸可使铁钝化。钝态的铁、钴、镍不再溶于相应的酸中,所以可以用铁罐贮存浓硫酸
在加热条件下,铁、钴、镍能与许多非金属剧烈反应。
13.5.2 铁、钴、镍的化合物
| 价电子构型 | 重要氧化值 |
Fe | 3d64s2 | +3 +2 (+6) |
Co | 3d74s2 | +2 +3 (+5) |
Ni | 3d84s2 | +2 +3 (+4) |
最高氧化值不等于族序数。这主要是因为随着原子序数的增加,原子的有效核电荷增加,增强了核对3d电子的束缚作用
铁、钴、镍的高氧化态化合物氧化性较强,大都以含氧酸盐或配盐的形式存在,例如:Na2FeO4,K3CoO4,K2NiF6等,这类化合物在水溶液中都极不稳定。
Fe3+,Co3+,Ni3+的氧化性按Fe3+<Co3+<Ni3+顺序增强,因此它们卤化物稳定存在状况见下表:

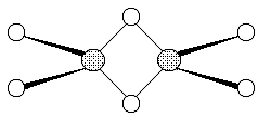
FeCl3有明显的共价性,易潮解。它的蒸气中含有双聚分子 Fe2Cl6,其结构为:
氯化钴CoCl2·6H2O在受热脱水过程中,伴随着颜色的变化:
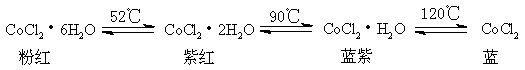
利用CoCl2·6H2O的这一特性指示出的吸水程度。
铁、钴、镍的其它化合物具有盐类的一般性质。
13.5.3 水溶液中铁、钴、镍的离子及其反应
⒈Fe(Ⅱ )、Fe(Ⅲ)、 Co(Ⅱ )、Ni(Ⅱ)的水解性
Fe(Ⅱ)、Fe(Ⅲ )在水溶液中分别以[Fe(H2O)6]3+(淡紫色)和[Fe(H2O)6]2+(淡绿色)的形式存在。钴和镍的盐类在水溶液中主要有[Co(H2O)6]3+(粉红色) 和[Ni(H2O)6]3+(绿色) 。
由于Fe3+比Fe2+的电荷多,因而Fe3+比Fe2+容易发生水解。
![]()
![]()
Co2+和Ni2+仅发生微弱的水解。
![]()
![]()
由于Fe3+水解程度大,[Fe(H2O)6]3+仅能存在于酸性较强的溶液中,稀释溶液或增大溶液的pH值 ,都会有胶状物FeO(OH)沉淀出来,使混浊的水变清。所以FeCl3常用作净水剂。
⒉沉淀反应
向Fe2+,Fe3+,Co2+,Ni2+溶液中加入强碱,分别生成相应的氢氧化物。
★ Fe(OH)2迅速被空气中的氧氧化,由白色→灰绿色→棕褐色,最终生成Fe(OH)3 。
★ 湿的 Co(OH)2也能被空气中的氧缓慢地氧化成暗棕色的Co2O3·xH2O(Co(OH)3):
4Co(OH)2 + O2 + 2(x-2)H2O → 2Co2O3·xH2O
★ Ni(OH)2需要在浓碱溶液中用较强的氧化剂(如溴水)才能把它氧化成黑色的NiO(OH)(Ni(OH)3)。
2Ni(OH)2 + Br2 + 2OH - → 2NiO(OH) + 2Br - + 2 H2O
★ Co(OH)2在同样条件下也可被氧化为Co(OH)3。
2Co(OH)2 + Br2 + 2OH- → 2Co(OH)3 + 2Br-
★ 由于Co3+,Ni3+具有很强的氧化性,在水溶液中很难有 [Co(H2O)6]3+和[Ni(H2O)6]3+存在。所以Co2O3,NiO(OH)与酸作用时,发生氧化还原反应:
2M(OH)3 + 6HCl(浓) → 2MCl2 + Cl2 + 6H2O (M=Co,Ni)
在氨碱性条件下,向Fe2+,Co2+,Ni2+溶液中通入H2S,能够生成MS沉淀。
FeS,CoS,NiS是稀酸溶性,即在稀酸条件下,向含有 Fe2+,Co2+,Ni2+离子的溶液中通入H2S是不会产生硫化物沉淀的。但当MS在氨碱性条件下形成后,CoS,NiS由于发生晶型转变而不再溶于酸。
⒊氧化还原反应
铁的元素电势图:

★ 在浓碱溶液中,用NaClO可以把Fe(OH)3氧化成紫红色的FeO42-:
2Fe(OH)3 + 3ClO- + 4OH- → 2FeO42- + 3Cl- + 5H2O
★ 酸性溶液中,Fe3+是中强氧化剂,能把I-,H2S,Fe,Cu等氧化:
2Fe3+ + H2S → 2Fe2+ + S + 2H+
2Fe3+ + Fe → 3Fe2+
2Fe3+ + Cu → 2Fe2+ + Cu2+
工业上常用FeCl3的溶液在铁制品上刻蚀字样,或在铜板上制造印刷电路。FeCl3溶液也叫做烂板剂。
★ 在酸性溶液中,Fe2+有一定的还原性(显然Fe2+的还原性比Fe(OH)2弱) (点击图片实验演示)。例如:空气中的氧能把Fe2+氧化为Fe3+:
4Fe2+ + O2 + 4H+ → 4Fe3+ + 2H2O
所以保存 Fe2+溶液时,应加入Fe。
⒋配合反应
★ 氨配合物
Fe2+,Fe3+与NH3不形成配合物:

在Co2+,Ni2+的溶液中加入氨水,先生成碱式盐沉淀,当氨水过量时,形成氨配合物。

[Co(NH3)6]2+具有较强的还原性 ,易被空气中的氧氧化为[Co(NH3)6]3+:
★ 硫氰配合物
鉴定Co2+
在鉴定Co2+的实验中,用固体的KSCN或NH4SCN引入SCN-根。
![]()
★ 氰的配合物

对应的盐类有:六氰合铁(Ⅱ )酸钾:K4[Fe(CN)6]俗称黄血盐,呈黄色。
六氰合铁(Ⅲ)酸钾:K3[Fe(CN)6]俗称赤血盐,晶体呈红色。
![]() ,
, ![]() 在碱性条件下都不稳定,分解为相应的氢氧化物:
在碱性条件下都不稳定,分解为相应的氢氧化物:



⒌有关离子的鉴定
★ 铁离子的鉴定
Fe2+的鉴定:在酸性条件下加入K3[Fe(CN)6]溶液 。

Fe3+的鉴定:除了可用KSCN外,还可用 K4[Fe(CN)6] 。

实验已证明,Prussian蓝和Turnbull's蓝的组成都是[KFeⅢ(CN)6FeⅡ]x。
★ Cu2+的鉴定:在弱酸性条件下,用K4[Fe(CN)6]溶液。
2Cu2+ + [Fe(CN)6]4- → Cu2[Fe(CN)6](s,红棕色)
★ S2-的鉴定:利用[Fe(CN)6]4-与硝酸作用后生成的[Fe(CN)5NO]2-鉴定S2-的存在:

★ K+的鉴定:把Na3[Co(NO2)6]溶液加到含有 K+的溶液中,则析出难溶于水的黄色晶体K2Na[Co(NO2)6]:

★ Ni2+的鉴定:在弱碱性条件下加入丁二肟生成难溶于水的鲜红色螯合物沉淀二丁二肟合镍(Ⅱ ) :

二丁二肟合镍简写作: Ni(DMG)2。
⒍重要反应小结

1 / 20
